細胞内カルシウムイオンの局所的な濃度変化が脳の原型づくりに重要である
発表概要
脳はすべての動物にとって必須の器官であり、ヒトではその形成異常は重篤な先天異常として知られています。脳の原型は受精卵から発生する過程の早い段階で、一層の細胞シートが折りたたまれてできるチューブ状の構造として明瞭になります。このチューブ構造が形成されるためには細胞の形態が大きく変化することが重要です。今回、基礎生物学研究所 形態形成研究部門の鈴木誠助教、原佑介研究員、上野直人教授らは、発生遺伝学研究部門の佐藤昌直助教、初期発生研究部門の小山宏史助教と藤森俊彦教授、京都大学の今村博臣准教授、大阪大学産業科学研究所の永井健治教授、カナダ・アルバータ大学のロバート・キャンベル教授との国際共同研究により、細胞内のカルシウムイオンの一過的・局所的な濃度変化が、細胞の形態変化を引き起こし、脳の原型づくりにおいて重要な役割を担っていることを明らかにしました。
研究の背景
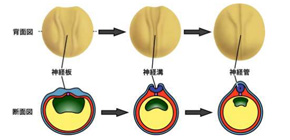
脊椎動物の脳や脊髄は受精卵から体の形が作られる過程の初期に形成されますが、その原型は細胞の集団が頭側からお尻側に沿ってチューブ状に集合した構造をしています。この構造は神経管(しんけいかん)と呼ばれており、背中の表面に出現した神経細胞の前駆体集団のシートが折れ曲がり、更に両端が融合して閉じることにより形成されます (図1) 。この時、細胞のシートを折り曲げる物理的な力が必要になりますが、これは主に細胞の形態が円柱状からボトル型やくさび型に変形することにより生じます (図2) 。この細胞の変形現象は頂端収縮(ちょうたんしゅうしゅく)と呼ばれ、細胞骨格のF-アクチンの動態が変化し、細胞の表面をきんちゃくの紐をしばるように窄(すぼ)めることにより引き起こされます。頂端収縮が十分に起こらないと神経管が適切に閉じることが出来ず、脳や脊椎が体の表面に異常に突出した状態に陥ります。この状態は神経管閉鎖障害と呼ばれ、心臓の異常に次いでヒトの新生児で二番目に起こりやすい重篤な先天異常として知られています。従って頂端収縮が起こる仕組みを理解することは、脳の原型ができるしくみ、そして重篤な先天異常の病因を理解することにつながります。
本研究を行った基礎生物学研究所の上野直人教授を中心とした研究グループは、脳のでき方がヒトに近い両生類のアフリカツメガエル(以下ツメガエル)を用いて神経管が形成される過程の研究を進めてきました。同グループは、脊索などの組織において細胞内のカルシウムイオン(Ca 2+ )濃度の変化が細胞の形態や運動の調節に関与することを見出していました。細胞内のCa 2+ は通常は低い濃度に保たれていますが、特定の刺激を受け取った細胞では濃度が上昇し、Ca 2+ と結合する様々なタンパク質の活性化に働くことが知られています。そこで鈴木誠助教らは、神経管が形成される際にも細胞内のCa 2+ 濃度が変化し、それが神経管の形成過程で機能しているのではないか?という仮説を立てて研究を行いました。
研究の成果
研究グループは、脳の原型である神経管が形成される過程における細胞内Ca 2+ の濃度変化に着目しました。まず、細胞内Ca 2+ の濃度変化を抑制する薬剤を処理する実験を行いました。その結果、予想したとおりツメガエルの神経管の形成が阻害されることが分かりました (図3) 。次に、神経管が形成される過程において細胞内のCa 2+ 濃度がどのように変化するかを調べるため、Ca 2+ 濃度に依存して明るさが変化する蛍光タンパク質GECO(Genetically-Encoded Ca 2+ indicators for Optical imaging)を用いて、神経管をつくる細胞集団の観察を行いました。その結果、細胞集団の一部において一過的に細胞内Ca 2+ 濃度が大きく上昇することを発見しました (図4) 。Ca 2+ 濃度の変化のパターンを統計学的手法により解析すると、変化パターンには一見してランダムに単細胞レベルで起こるケースと、隣接する複数の細胞で同調して起こるケースの2種類があり、その変化の数と割合が刻々と変化していくことが分かりました (動画) 。また興味深いことに、Ca 2+ 濃度の大規模な変化が起こった直後に細胞シートが折れ曲がるスピードが一時的に速まる傾向が見出されたことから、研究グループはCa 2+ 濃度の変化が頂端収縮を速やかに誘導しているものと予想しました。これを検証するために個々の細胞での解析を進めた結果、Ca 2+ 濃度の変化に引き続き、細胞の形態変化に関わる細胞骨格のF-アクチンの細胞内での分布が大きく変化し、続いて頂端収縮が起こることが分かりました (図5) 。
加えて、光でCa 2+ 濃度上昇を誘導する技術を用いて人為的に細胞にCa 2+ 濃度の変化を与えると頂端収縮が起こったことから、細胞内Ca 2+ はF-アクチンの動態の変化を介して頂端収縮を引き起こし、神経管の閉鎖運動を促進していることが示唆されました。更に研究グループはアデノシン三リン酸(ATP)感受性の蛍光タンパク質ATeam を用いた解析などにより、細胞内のCa 2+ 濃度が細胞外のATP による刺激により制御されていることを示し、神経管形成における細胞の形態変化に至る制御機構の一端を明らかにしました。
本研究ではこれらの実験結果を元に、細胞シートの折れ曲がり現象を数理モデル化することにも成功しました。この新たな数理モデルを用いて細胞内のCa 2+ 濃度の変化パターンが細胞シートの折れ曲がりに与える効果の性質を探ったところ、ランダムに単細胞レベルで起こるCa 2+ 濃度の変化が効率的に折れ曲がりを促進する一方、複数細胞で同調して起こるCa 2+ 濃度の変化は折れ曲がりを素早く引き起こせるものの、その効率は高くないことが予測されました。そこで、実際に神経管形成時のCa 2+ 濃度の変化パターンと管形成の関係について得られたデータの統計学的な解析を行うと、この予測が正しいことが分かりました (図6) 。以上より、数理モデルの妥当性が裏付けられたと同時に、2つの細胞内Ca 2+ の濃度変化パターンが異なる生理的意義をもつことなど、新たな神経管形成の仕組みの理解につながりました。
今後の展望
本研究によりツメガエルの神経管形成メカニズムの一端が新たに明らかになりました。頂端収縮の仕組みや神経管が形成される過程は脊椎動物の間で高度に保存されていることから、本研究の成果はヒトを始めとする脊椎動物の脳が形成される過程の一般的な理解につながることが期待されます。また頂端収縮は心臓、肺、腎臓、眼といった器官が形成される過程でも起こることから、細胞内Ca 2+ がそれら他の器官の形成過程でも機能している可能性があります。神経管で細胞内Ca 2+ の濃度変化が起こる仕組みやF-アクチンの動態変化につながる分子機構の詳細、さらに他の器官における細胞内Ca 2+ の濃度変化についてはまだ不明な点も多くあり、これらを明らかにするために研究を続けることが必要です。
本研究ではランダム性を伴った単細胞レベルの細胞内Ca 2+ の濃度変化によって起こる頂端収縮が効率的な細胞シートの変形を引き起こすことが示されました。一方で、物理的な障害によって成体の表面に傷が生じた際には、細胞内Ca 2+ の濃度変化が複数の上皮細胞で同調的に起こる傾向が強く、それが傷口の速やかな閉鎖に寄与している可能性が示されています。その時々の状況に応じて細胞内Ca 2+ の濃度変化が異なるパターンで生じることの意義は興味深い課題であり、細胞内Ca 2+ の濃度変化と頂端収縮のパターン、更に細胞シートの変形効率の間に存在する因果関係について、今後も統計的手法や数理モデルを活用した統合的な解析により理解を深めることが重要であると考えられます。
参考図
図1 ツメガエルの神経管が形成される過程の模式図
図2 細胞シートの折れ曲がりと細胞の形態の変化
神経管をつくる細胞(濃い青色)では細胞骨格F-アクチンの動態が変化することで表層(頂端側)が収縮する。これが細胞を変形させる物理的な力になる。複数の細胞が変形することによって、細胞シートは体の中心方向に折れ曲がる。
図3 細胞内Ca 2+ の濃度変化を抑制する薬剤の処理実験の結果
背面図の黄色の点線が神経管形成領域。薬剤処理により折れ曲がり運動が遅れていることが断面図からも分かる。
図4 蛍光タンパク質GECO による細胞内Ca 2+ 濃度変化の観察
細胞内Ca 2+ 濃度の上昇が隣接する複数の細胞で同調して起こるケース。1細胞で生じた蛍光強度の変化(矢印)が周辺の細胞に伝搬している。
図5 細胞内Ca 2+ 濃度変化による頂端収縮の模式図
図6 細胞内Ca 2+ 濃度の変化パターンと折れ曲がり効果の関係
動画 蛍光タンパク質GECO による神経管形成過程のCa 2+ 動態の可視化
http://movie.biologists.com/video/10.1242/dev.141952/video-1
発表雑誌
雑誌名:Development3月28日掲載(2月20日オンライン先行公開)
論文タイトル: Distinct intracellular Ca 2+ dynamics regulate apical constriction and differentially contribute to neural tube closure
(細胞内のカルシウムイオン動態は異なる2つのパターンで頂端収縮を調節し神経管の閉鎖に寄与する)
著者:Makoto Suzuki, Masanao Sato, Hiroshi Koyama, Yusuke Hara, Kentaro Hayashi, Naoko Yasue, Hiromi Imamura, Toshihiko Fujimori, Takeharu Nagai, Robert E. Campbell, Naoto Ueno
DOI:10.1242/dev.141952
研究グループ
基礎生物学研究所 形態形成研究部門の鈴木誠助教、原佑介研究員(現シンガポール国立大学)、上野直人教授ら、発生遺伝学研究部門の佐藤昌直助教(現北海道大学)、初期発生研究部門の小山宏史助教と藤森俊彦教授、京都大学の今村博臣准教授、大阪大学産業科学研究所の永井健治教授、カナダ・アルバータ大学のロバート・キャンベル教授による国際共同研究グループによる成果です。
研究サポート
本研究は、文部科学省科学研究費助成事業のサポートを受けて行われました。
参考URL
産業科学研究所 生体分子機能科学研究分野(永井研)
http://www.sanken.osaka-u.ac.jp/labs/bse/
